Farmaceutski pogoni imaju obavezu da poštuju GxP standarde i regulative. U skladu sa GAMP,
FDA 21 CFR Part 11 i EU GMP Anenex 11, validacija opreme i sistema je obaveza proizvođača.
- Validacija i kvalifikacija sistema i opreme
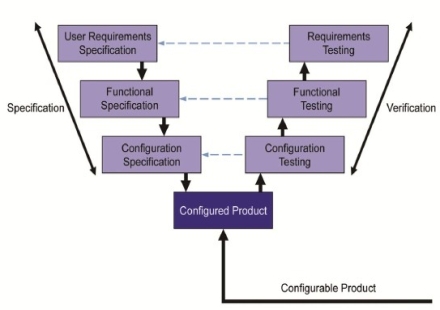
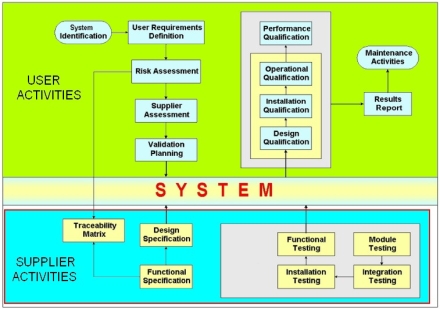
Validacija i kvalifikacija opreme i kompjuterskih sistema je dokumentovani dokaz da novi ili izmenjeni
sistem automatike obezbeđuje integritet proizvodnih procesnih podataka. Kvalifikaciona dokumentacija se
izrađuje od početne do završne faze projekta. Naš tim može da obezbedi validacionu i kvalifikacionu dokumentaciju
kao što su User Requirements Specification - URS, Quality Plan - QP, Risk Analysis - RA, Design Qualification - DQ
(Functional Design Specification - FDS, Hardware Design Specification - HDS), Functional Specification - FS,
Configuration Specification - CS), Installation Qualification - IQ, Operational Specification - OQ,
Performance Qualification - PQ.
|